|
|

|
基因组稳定性调控 蔡刚课题组专注解析ATM/ATR蛋白质机器的组装机制、结构动态变化、筛选结合底物及其激酶活性严谨调控的分子机制;指导高效和高特异性的ATM/ATR激酶抑制剂的设计,作为新型肿瘤治疗的药物。 基因组稳定性维持是一切生命活动的基础,然而,多种外源和内源因素作用下产生的广泛DNA损伤和复制压力,构成了基因组不稳定的主要来源。DNA损伤应答(DNA-damage response, DDR)通过介导DNA损伤信号传导、DNA修复、细胞周期调节和细胞凋亡的途径,关键性地维持维持基因组稳定。
DNA损伤应答的中心是两种关键激酶:ATM(共济失调 -毛细血管扩张突变,及其酵母同源蛋白Tel1)和ATR(共济失调 - 毛细血管扩张和Rad3相关,及其酵母同源蛋白Mec1)。ATM/Tel1和ATR/Mec1激酶在细胞周期阻滞、DNA修复、细胞凋亡、维持染色体的稳定性、防止畸变甚至癌变的过程中发挥着重要作用,在DNA损伤条件下能直接磷酸化下游将近1000个底物(包括p53蛋白,细胞周期调控蛋白、直接参与DNA损伤修复等关键蛋白质),形成了一个庞大而复杂的蛋白质相互作用的网络,呈级联放大效应地传递磷酸化信号,全局性地调控基因组的稳定。
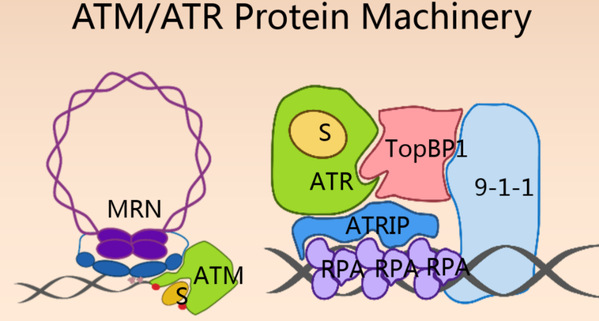
ATM和ATR激酶是DNA损伤的感应器,负责保护基因组的稳定性 ATM/ATR激酶的活性调控研究具有揭示基因组稳定性调控机制的重大科学意义。解析ATM和ATR激酶的三维结构,并在此基础上理解ATM和ATR活性严谨调控的分子机制,不仅具有阐明基因组稳定性调控的重大科学意义,也将对肿瘤放射治疗的新型增敏剂的研发起到重要的指导作用。前期工作中,我们解析了分辨率8.7埃的ATM/Tel1激酶的三维结构。该结构是ATM第一个冷冻电镜结构,部分揭示了ATM 激酶活性严谨调控的结构基础(Nature communications, 2016);解析了3.9埃分辨率的ATR/Mec1-ATRIP/Ddc2复合物的结构,该结构揭示了ATR激酶活性在同源二聚体中活性抑制和激活的分子机制(Science, 2017)。
我们正在选取 ATM/ATR 激酶与 MRN、RPA、9-1-1、NuA4/TIP60、SWI/SNF 复合体等所形成的超大蛋白复合物进行结构生物学研究,阐明这类蛋白质机器的组装、动态变化及其突变致病和增强肿瘤易感性的分子机制机制。重点研究相关这些复合物如何组装(尤其是各亚基之间相互作用的细节)、如何感受到 DNA 损伤信号而发生动态变化及其激酶活性严谨调控的分子机制。 ———————————————————————— 转录中介体的结构和功能 转录中介体是特异转录因子与RNA聚合酶Ⅱ基本转录起始前复合体之间的联接桥梁,中介体能整合不同的转录调控信号,通过发生相应的构象变化,促进或者阻止转录分子机器的组装和稳定, 精确调节真核生物的基因表达。中介体是由几十个不同蛋白质组成的复合体中介体由头部、中部、尾部3个稳定模块和可解离的Cdk8激酶模块构成。中介体的模块化结构和亚基组成从低等的酵母到高等哺乳动物高度保守。
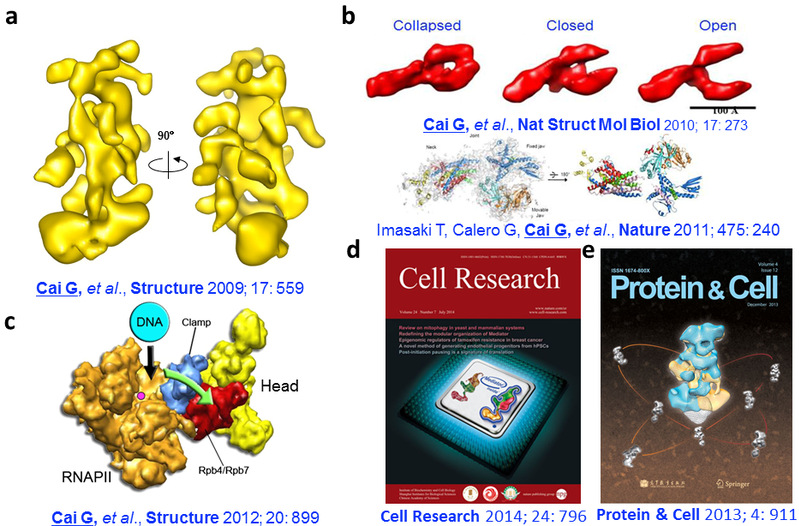
我们从2006年起专注于转录中介体的结构和功能研究,建立了一种高效制备组成复杂蛋白质复合体的方法,解析中介体首个冷冻电镜结构,头部模块及其与RNA聚合酶复合物结构,揭示头部模块结构柔性调节RNA聚合酶构象调控转录起始的机制(Nature Structural and Molecular Biology,2010, Nature 2011, Structure, 2009, 2012等);近五年来首次清晰解析转录中介体的模块架构,纠正了之前错误的认识,为阐明中介体调控转录的分子机制打下了坚实的基础(Cell Research,2014,封面故事);另外还解析Cdk8激酶模块的结构柔性及其与中介体核心模块的动态相互作用(Protein & Cell,2013,封面故事)。
我们解析的转录中介体的结构和功能性相互作用 a,解析首个中介体的冷冻电镜结构。b,中介体头部模块的冷冻电镜和晶体结构的解析。c,解析头部模块及其与 RNA 聚合酶复合物结构,揭示头部模块结构柔性调节 RNA 聚合酶构象调控转录起始的机制。d,首次清晰解析转录中介体的模块架构。e,解析 Cdk8 激酶模块的结构柔性及其与中介体核心复合物的动态相互作用。 |
地址:电话:Email: 制作维护 |